傷を修復する新たなメカニズムを発見
TRPV3が表皮細胞の損傷修復機能に関与
2023年02月28日 16:45
343名の医師が参考になったと回答
 © Adobe Stock ※画像はイメージです
© Adobe Stock ※画像はイメージです
2021年のノーベル生理学・医学賞は「温度と触覚の受容体研究」が受賞した。受賞対象である温度受容体のTRPV1チャネルは温度感受性TRPチャネルに属し、TRPチャネルに含まれるその他の受容体も生命現象に深く関わるとしてそれぞれ研究が進んでいる。自然科学研究機構生理学研究所教授の富永真琴氏らの共同研究グループは、TRPチャネルの1つであるTRPV3が皮膚の損傷を修復する表皮細胞機能に深く関与すること、損傷の修復における新たなメカニズムが明らかになったことをCommun Biol (2023; 6: 88)に報告した。今回の知見は、損傷治療法の開発につながることが期待されるという。
表皮細胞に存在するTRPV3とANO1の関与を検討
損傷した皮膚は、周囲の表皮細胞が増殖して傷口を覆うように移動することで修復される。表皮細胞の増殖と移動には、表皮の大部分を占めるケラチノサイトに強く発現するTRPV3が関わることは知られていたが、細胞機能を制御するメカニズムについては不明であった。
研究グループはこれまでに、TRPV1やTRPA1などのTRPチャネルの活性化を介して同一細胞に存在するクロライドイオンチャネルのanoctamin1(ANO1)の活性化が促され、疼痛を増幅することを明らかにしている。TRPV3と同じくANO1も表皮細胞に認められることから、今回、①TPRV1などと同様にTRPV3の活性化がANO1の活性化を誘導するのか、②活性化されたANO1は損傷の修復にどのように関わるのか−について検討した。
ANO1によるクロライドイオンの細胞内流入が損傷の修復に重要な役割
研究グループはまずTRPV3の活性化がANO1の活性化を誘導するか否かを、ヒト表皮細胞を用いて検討した。その結果、TRPV3を活性化するカンフル(樟脳)を表皮細胞に作用させるとクロライドイオンチャネルに由来する電流が流れ、ANO1チャネル阻害薬の添加により電流が弱まることが認められた。これは、TRPV3の活性化がクロライドイオンチャネルであるANO1の活性化を誘導することを示している。
次に、表皮細胞の培養シートを用いた人工傷モデルにおける治癒過程を、ANO1阻害薬の有無別に観察した。その結果、ANO1阻害薬のない人工傷モデルでは実験開始12時間後には表皮細胞の増殖と移動によって損傷が埋まり始めるが、ANO1阻害薬の存在下ではほとんど埋まらないことが認められた(図)。この結果から、ANO1が損傷の修復に関わる表皮細胞の機能を促進すると考えられた。また、12時間後に阻害薬を除去したモデルでは24時間後に傷が埋まり始めていることから、ANO1阻害薬は細胞を破壊する作用を持たないことが示された。
図. ANO1阻害薬の有無別に見た人工傷モデルの修復過程
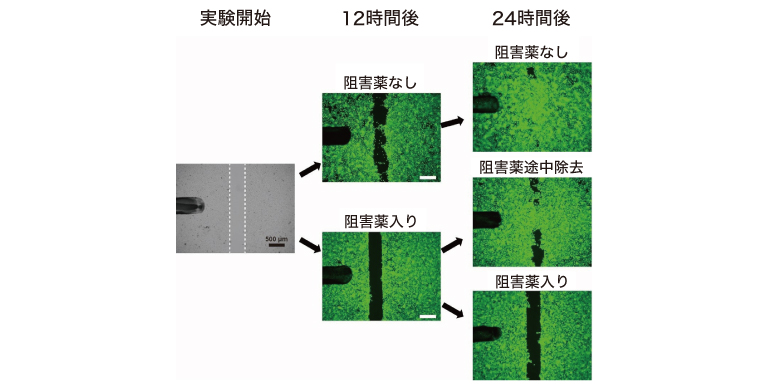
(生理学研究所プレスリリースより)
同様の実験をクロライドイオンを減らした低クロライド培養液中で行ったところ、通常の培養液と比べて表皮細胞の増殖、移動がともに抑制され、ANO1阻害薬の存在下と同様の現象が認められた。また、表皮細胞内のクロライドイオン濃度が細胞外よりも低く保たれていることも分かった。
以上の結果から、クロライドイオンの細胞内への流入が表皮細胞における傷の修復に関与し、それを制御するのは表皮細胞に存在するTRPV3とANO1であると考えられた。研究グループは「TRPV3により活性化されたANO1を介し、細胞内にクロライドイオンが流入することが表皮細胞の損傷の修復において重要である」と結論し、今回明らかになった損傷治癒のメカニズムは新たな治療法の開発に役立つと展望している。
(野田優子)






